シャルルの法則(絶対温度と体積の関係)をシミュレーターを用いて解説![物理入門]
前回記事では、ボイルの法則について解説しました。温度が変わらない状況下なら、圧力と体積が反比例するという法則です。
今回の記事では別の観点で、「絶対温度」と「体積」の関係について説明していきます。この2つの関係はシャルルの法則というもので説明できます。
![シャルルの法則(絶対温度と体積の関係)をシミュレーターを用いて解説![物理入門]](https://retu27.com/wp-content/uploads/rapture_20210503200819-367x500.jpg)
等圧条件下で、「絶対温度」と「体積」は比例する!
気体の「絶対温度」と「体積」の関係について説明します。その関係性に焦点を当てるため、圧力は変えないものとします。
この時、絶対温度をT(K)、体積をV(\(m^3\))とすると、↓のシャルルの法則が成り立ちます。
\( \displaystyle \frac{V}{T} = 一定\)
* 圧力Pが一定の条件下
つまり絶対温度と体積は比例するという事です。これは、「絶対温度が上がる→分子の運動が激しくなる→等圧条件下では体積が大きくなる」という因果関係によるものです。温度が上がって、分子の動きが激しくなり、壁を押して体積が変化するのです。
「絶対温度2倍 ⇒ 体積2倍」になります。注意が必要なのは、Tはセ氏温度ではなく、絶対温度ということです。
この「絶対温度」と「体積」が比例する理由は分子の動きを計算すれば分かるのですが、、、その証明は別記事で解説する予定です。まずはこのような関係性があることを理解しましょう!
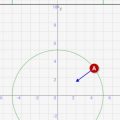
シミュレーターでシャルルの法則を理解しよう!
上記で説明したボイルの法則を、シミュレーターを使って理解しましょう!
- 圧力Pは変わらない等圧条件下のシミュレーションです
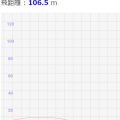
- スライドバーで絶対温度を変更でき、その結果が↓シミュレーターで表示されます
- その結果、変化した体積Vが画面に表示されます
↓のスライドバーを動かして、「圧力」と「体積」が反比例することを確認しましょう!
次回、ボイル・シャルルの法則を解説します!
今回は絶対温度Tと体積Vの関係性について説明しました。繰り返しになりますが、等圧条件では↓の式が成り立ちます。
\( \displaystyle \frac{V}{T} = 一定\)
つまり、「絶対温度」と「体積」は比例するんです。
次回は前回記事のボイルの法則と、今回解説したシャルルの法則の合わせた場合を解説します!
- 圧力一定なら、絶対温度と体積は完全比例する
⇒「ボイル・シャルルと状態方程式」カテゴリ記事一覧
その他関連カテゴリ