化学反応/活性化エネルギーをシミュレーターを用いて解説![化学入門]
前回までの記事で、化学結合と結合エネルギーについて説明していきました。
今回は、その結合エネルギーの考え方をベースに、化学反応/活性化エネルギーについて解説していきます!
![化学反応/活性化エネルギーをシミュレーターを用いて解説![化学入門]](https://retu27.com/wp-content/uploads/20220525001521b-490x500.png)
目次
おさらい:結合エネルギー = 2つの原子結合を切り離すために必要なエネルギー
今まで様々な化学結合について説明してきましたが、実は結合している状態のほうがエネルギー的に低い状態であり、安定した状態なのです。
↓の図がそれを示したものです。青丸は原子を示しています。縦軸が原子/分子が持つエネルギー量を示しています。図にある通り、一般的にエネルギーは「乖離状態 > 結合状態」になるんです。2原子が結合している状態より、乖離してバラバラの状態のほうがエネルギーが高いんです。

逆にいうと「結合している原子は、エネルギーを加えないと切り離せない」ということです。それぐらいガッチリ結合してるということなんですね。
そして、↑図のエネルギー差が「2つの原子を切り離すために必要なエネルギー」であり、つまり「結合エネルギー」であるんです!
化学反応について
化学反応とは?
化学反応とは「ある分子/原子から、ある分子/原子から推移する反応」です。例えば酸素でいうと↓のように、結合されていたものが分解することも化学反応の一種です。

化学反応は、分子のエネルギー準位に従って発熱/吸熱する
前回記事で、原子が結合すると発熱してエネルギーを放出して、エネルギー準位が下がるという話をしました。↓の図のように結合する時に熱を放出するわけです。

化学反応でもこの考え方は同じです。化学反応に関係する原子/分子全体でエネルギーを考えた時、その前後のエネルギーの差で↓のように反応熱の方向が変わります。
「反応前のエネルギー < 反応後エネルギー」 ⇒ 吸熱反応
例えば、反応で出来た分子のエネルギーのほうが低ければ、発熱反応になるわけです!
活性化エネルギー = 化学変化を起こすために必要なエネルギー量
水素/酸素と水分子の関係をエネルギー準位で表すと↓のような図になります。一番複雑な結合をする水分子が最下位のエネルギーで、次に水素/酸素分子、最上位が水素原子と酸素原子がバラバラの状態になります。

では、中位の水素/酸素分子から、下位の水分子にすぐに移動/化学反応できるかというと、、、そうではないんです。
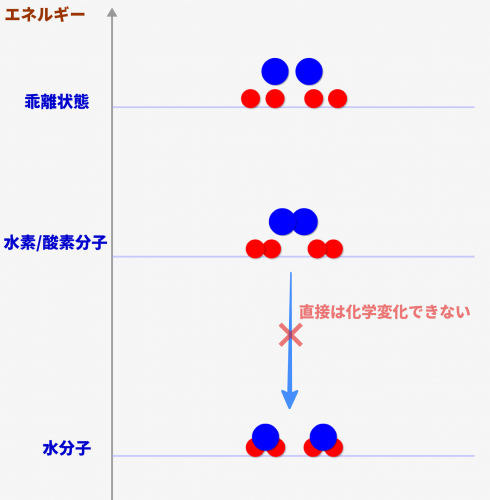
実際は「水素分子/酸素分子が結合しているため、その結合が解けるぐらいまで熱を加える」必要があるんです。
そのため、↓のような経路でないと水分子になることが出来ません。少しだけ加熱して、結合をほぐさないといけないのです。このように「ある分子を活性化させて変化出来る状態にするために必要なエネルギー」を活性化エネルギーといいます。

化学反応を進行させるために、追加で必要なエネルギー
今回は水分子での例で説明しましたが、他の原子/分子でもこのように反応のために「活性化エネルギー」が必要になります。
化学反応/活性化エネルギーをシミュレーターをシミュレーターを用いて確認しよう!
それでは具体的な化学反応/活性化エネルギーのイメージを理解するために、シミュレーターで実験してみましょう!
- 初期状態が水素/酸素分子の状態です(青が酸素,赤が水素を表しています)
- ↓の加熱ボタンを押すと、熱が加わり、エネルギー準位が高まっていきます
- ある程度加熱すると、活性化エネルギーに到達し、発熱反応となって水分子が生成されていきます
- 反応の流れを観察してみましょう!
↓加熱ボタンを押してみてください!
* リセットで初期状態から再実行できます。
- 分子や原子のエネルギー準位の差によって、化学反応が発熱反応になるか吸熱反応になるかが決まる
- ただし、エネルギーが低い方向に自然と向かうわけではない。反応を活性化させるために、活性化エネルギーを加える必要がある
⇒「化学反応」カテゴリ記事一覧
その他関連カテゴリ