化学反応速度・化学平衡を用いて解説![化学入門]
前回までの記事で、化学反応の基礎について説明しました。原子を組み替えて、分子の構造が入れ替わるのが化学反応です。
今回は、「化学反応速度」「化学平衡」について解説していきます!
![化学反応速度・化学平衡を用いて解説![化学入門]](https://retu27.com/wp-content/uploads/20220525191141-485x500.png)
目次
おさらい:化学反応について
化学反応とは「ある分子/原子から、ある分子/原子から推移する反応」です。例えば酸素でいうと↓のように、結合されていたものが分解することも化学反応の一種です。

化学反応には「反応速度」がある
反応速度
原子/分子が化学反応で変化していくときに「化学反応速度」というものが考えれれます。
化学反応の中には一瞬で終わるものもあれば、何時間もかけて進むものもあります。
今、↓のような化学反応を考えます。AからBに変化する化学反応です。
A ⇒ B
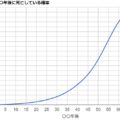
このような化学反応に対して、化学では反応速度を↓のようなグラフで表します。これは「横軸 = 時間」「縦軸 = 対象原子/分子の濃度」で表したグラフです。赤が変化前のA、青が変化後のBの濃度になります。このように少しずつAからBに変化していくわけです。

このグラフを見れば、時間あたりの反応速度が分かります。曲線の傾きが大きい最初ほど、反応速度が高いわけです。また、変化前分子と変化後分しの割合は↑のように真逆の濃度グラフになるんです。
化学平衡 = 巨視的に見ると、反応が止まった状態
実際の化学反応は↑のように完全にA⇒Bに変化するのではなく、↓のようにAとBが一定の比率になったところで反応が止まったような動きになります。この状態を「化学平衡」といいます!

実は、化学平衡の状態では、化学反応は継続しています。それは何故かというと「B⇒Aという逆の反応も起こるため」です。実は化学反応は一方向だけでなく、両方向で進んでいるんです!
そして、化学平衡の状態は↓のような状態になっているんです。
「A ⇒ Bの反応速度」 = 「B ⇒ Aの反応速度」
つまり、A⇒Bで生成されるBと、B⇒Aで失われるBの量が一致したときが化学平衡状態なんです!↑のグラフだけ見ると反応が止まったように見えますが、実は内部ではA⇔B両方向で化学反応が進んでいるんです。
化学反応は、生成前分子の濃度で決まることが多い!
化学反応の速度ですが「生成前の分子の濃度」に比例することが多いです。式にすると↓のようになります。
「A ⇒ Bの反応速度」 = \(k_A[A]\)
「B ⇒ Aの反応速度」 = \(k_B[B]\)
[A]は「Aの濃度」、[B]は「Bの濃度」を表す化学の記号です。そして反応速度は↑の係数\(k_A[A]\),\(k_B[B]\)で決まるわけです。この\(k_A[A]\),\(k_B[B]\)が大きいほど素早く反応が進むわけです。また、化学平衡の条件を考えると↓のように計算ができます。
\(k_A[A]\) = \(k_B[B]\)
↓変形
\(\large \frac{[B]}{[A]}=\frac{K_A}{K_B}\)
つまり、BとAの比率は、化学反応速度係数の\(k_A\),\(k_B\)の比率で決まるわけです!
化学反応速度・化学平衡をシミュレーターを用いて確認しよう!
それでは具体的な化学反応速度・化学平衡をシミュレーターで確認してみましょう!今回は↑で解説してきたように「A⇒B」の化学反応という反応について考えていきます。
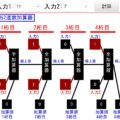
- 初期状態の全てAの状態からA⇒Bの化学反応が進んでいきます(逆反応も同時に進む)
- ↓のスライドバーで、反応速度を決める\(k_A\),\(k_B\)を変更できます
- ↓の実行ボタンを押すと、反応がはじまります。実際にAがBに変化していく様子と、濃度の変化グラフをリアルタイムで確認できます
- \(k_A\),\(k_B\)によって平衡状態になる割合が変わることを実験して確認してみましょう
- 平衡状態でも両方向で反応は進んでいることを確認してみましょう
* 今回は1000程度の分子を\(k_A\),\(k_B\)に従ってランダムで化学変化の発生を決めてシミュレーションしているため、キレイなグラフにはなりません
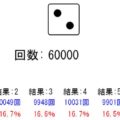
シミュレーター結果の考察
シミュレーター上の化学反応「A ⇒ B」と「B ⇒ A」はランダムで発生させていますが、実際にシミュレートすると↓のように平衡に向かうのがわかると思います。今回はシミュレートしている分子の個数が少ないですが、大量の分子になると変動がなくキレイに平衡状態になるわけです!
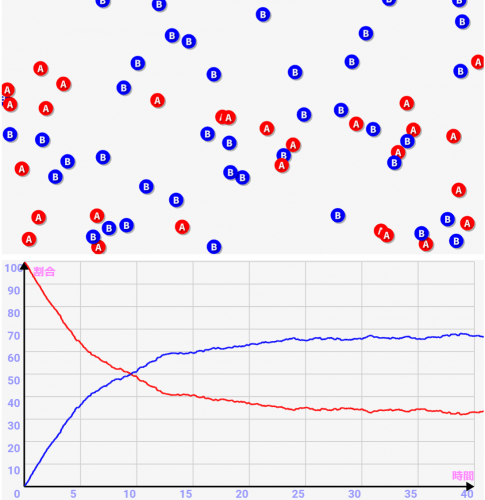
- 化学反応には速度があり、正方向だけでなく逆方向にも一定速度で反応が進んでいる
- ある濃度の地点で外から見ると反応が止まったように見える。これを「化学均衡」という。実際は両方向の反応速度が同じになっているだけで、反応は繰り返し起こっている
⇒「反応速度」カテゴリ記事一覧
その他関連カテゴリ