「原子のオクテット則」をシミュレーターで理解しよう![化学入門]
前回記事から化学の分野についての解説をしていきます。化学で一番の基礎といえるのが「原子」です。
本記事では「原子のオクテット則」を解説していきます!
![「原子のオクテット則」をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220501131337-500x415.png)
目次
おさらい: 価電子 = 一番外側に配置される電子のこと
価電子について説明します。原子は種類によって様々な性質を持ちますが、そのような原子の性質は「一番外側の電子=最外殻にある電子」によって決まることが多いです。
この「最外殻にある電子」のことを「価電子」といいます!
原子の性質を決める「最外殻にある電子」のこと
例えば↓のマグネシウムの例では、M殻にある2個の電子が価電子になります!
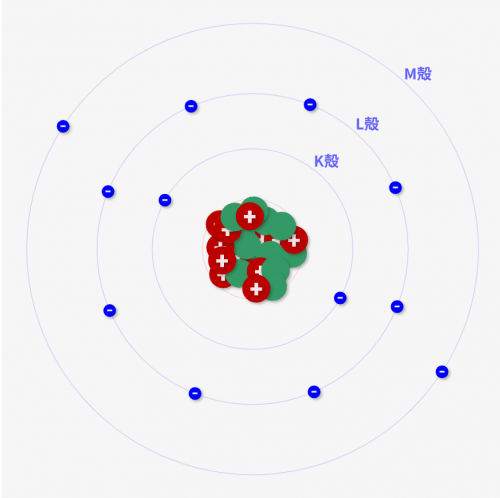
特にこの「価電子の数」が非常に重要なのです!
オクテット則 = 安定的な価電子の個数があるという法則
上記のように価電子は求められるのですが、原子の動きを決める中で重大な法則がありました。それがこの「オクテット則」です。
価電子には安定的になる個数がある
原子というのは不安定で、安定的でないと何らかの化学反応を起こして他原子と結合を起こしたりします。その安定性を決めるのがこの「オクテット則」です。
具体的にいうと↓のような動きになります。
- 価電子は、「その電子軌道が満員」or 「価電子8個」になったときに安定となる
- それ以外の場合、電子を排出したり、逆に吸引したりして、その状態になろうとする
例えば、Neは↓のように価電子が8となります。そのため、非常に安定的な元素です。

それに対して、Fは↓のように価電子が7です。そのため、価電子を8にしようと「電子を他から吸引して取り込む」ような力が働きます。

逆にNaは↓のように価電子が1です。この場合、1個電子が余分なので逆に「電子を排出する」ような力が働きます。

このように、「価電子の数が、安定的な8と比べて多いか少ないか」によって、動きが変わるんです!これによって元素の性質が決まってくるため、「同じ価電子の原子は同じような動きをする」といえるんです。
だからこそ周期表では原子を「族」として、グループ化してるんですね。
ちなみに何故8かというと、、、これは非常に難しいです。「3次元で構造的/空間的に安定する数 = 8」と覚えればよいと思います!
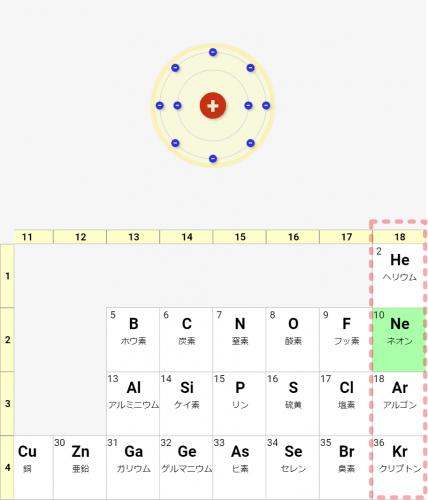
貴(希)ガス = 18族。オクテット則を満たす安定的な配置となるグループ
上記の様に考えると、18族は価電子が8となるはずであり、必ずオクテット則を満たして安定するはずなんです(ヘリウムは価電子2個で安定)。
そのため、18族は安定的な原子となり、単独で存在していることが多いです。逆にいうと、他の原子とあまり反応したりしません。
このような性質を持つ18族を貴(希)ガスと言います!
↓一番右の18族が貴(希)ガス
「原子のオクテット則」をシミュレーターで計算してみよう!
それでは、↑のオクテット則をもとに、各原子の電子の状態を確認してみましょう!
- ↓のスライドバーで原子番号を選択すると、↓で「価電子の配置と、電子の動き」が確認できます
- 周期表では、現在選択している原子を緑背景で表示します
- 電子がオクテット則を満たす場合、原子が黃色背景になります
- 矢印は「電子を放出しようとする力」「電子を吸引しようとする力」を表しています
- 価電子が8になるような方向に電子が動こうとすることを確認しましょう!
縦の列で「族」、横の行で「周期」を表しています。
各原子の電子の動き
原子によって差異があるのですが、基本的には価電子数によって↓のような動きになります。
価電子 1~3 ⇒ 余分な電子を放出
価電子 6~7 ⇒ 足りない電子を取り込む
価電子 8 ⇒ 安定
気になるのは価電子4,5の場合ですが、、この場合はイオンになるのでなく、別な方法を使って安定的な形になろうとします。
ここについては「化学結合」の記事で解説します。
まとめ:価電子の数で、原子の動き/性質がだいたい分かる!
今回は「原子のオクテット則」について解説しました。原子には安定的な価電子数=8があります。この数より価電子が多いか少ないかで、原子が安定するか、それとも電子を放出/取り込みするかが変わってくるんですね。
なので、「原子にどのような性質があるか考えるときには、まず価電子を見る」が重要なんです。
次回からは、この「オクテット則」の性質を考慮して、「原子の化学結合」について考察していきます!

- 電子には安定的な配置があり、それは最外殻の価電子の状態で決まる
- 価電子は満杯 or 8個の状態が一番安定する
- 価電子が8個以外の場合は、その数になろうと電子を放出しようとしたり、電子を吸収しようとする力が働く
⇒「元素の構成」カテゴリ記事一覧
その他関連カテゴリ