「イオン結合」をシミュレーターで理解しよう![化学入門]
前回までの記事で、化学の原子についての解説をしてきました。今回からはそれを用いて「化学結合」について解説していきます!
本記事では「イオン結合」を解説していきます!
![「イオン結合」をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220504143435-500x338.png)
目次
おさらい:オクテット則 = 安定的な価電子の個数があるという法則
上記のように価電子は求められるのですが、原子の動きを決める中で重大な法則がありました。それがこの「オクテット則」です。
原子というのは不安定で、安定的でないと何らかの化学反応を起こして他原子と結合を起こしたりします。その安定性を決めるのがこの「オクテット則」です。
具体的にいうと↓のような動きになります。
- 価電子は、「その電子軌道が満員」or 「価電子8個」になったときに安定となる
- それ以外の場合、電子を排出したり、逆に吸引したりして、その状態になろうとする
例えば、Neは↓のように価電子が8となります。そのため、非常に安定的な元素です。

それに対して、Fは↓のように価電子が7です。そのため、価電子を8にしようと「電子を他から吸引して取り込む」ような力が働きます。

逆にNaは↓のように価電子が1です。この場合、1個電子が余分なので逆に「電子を排出する」ような力が働きます。

このように、「価電子の数が、安定的な8と比べて多いか少ないか」によって、動きが変わるんです!これによって元素の性質が決まってくるため、「同じ価電子の原子は同じような動きをする」といえるんです。
イオン = 「一つ電子が足りない原子」と「一つ電子が余剰な原子」で電子を受け渡してオクテット則を満たしたもの
上記のおさらいのように、価電子(最外殻電子)8以外のものは不安定の状態です。不足してるものは電子を吸引しようとするし、余分なものは放出しようとします。
そのために、「一つ電子が足りない原子」と「電子の余剰がある原子」で↓のような電子の受け渡しが発生するんです!これによって作られる状態を「イオン」といいます!
シミュレーターで確認しよう!:NaとClのイオン
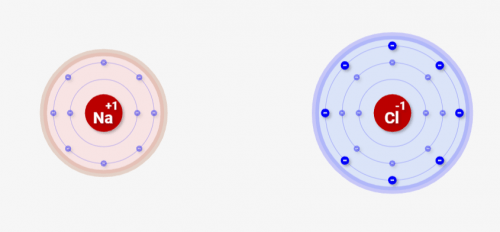
↓の例ではNaが価電子1で余剰有り、Clが価電子7で不足の状態になっています。この場合、NaからClへの電子の受け渡しが発生します。
↓「実行」ボタンを押してみてください!
* マイナスイオンを青色で、プラスイオンを赤色で示しています
電子の受け渡しの結果、両方とも価電子8となり安定となります。
また、↓のようにNaは電子を渡したためプラスイオン、Clは電子を受け取りマイナスイオンになります。これを原子のイオン化といいます。
イオンは上記シミュレーターにもありますが、上付き文字で電荷の状態を表します。今回の場合は電子が±1されたので、↓のように表します。
\( \Large{Na^{+1}}\) Naが電子を1つ失って+1の電荷を帯びていることを示す
\( \Large{Cl^{-1}}\) Clが電子を1つ貰って-1の電荷を帯びていることを示す
イオン結合 = イオン化の結果、互いのイオンが引き合うことによる結合
イオン結合の結果、2つのプラスとマイナスのイオンが出来上がります。
イオンというのは、電荷を持ちます。そして電荷はコチラの物理の記事で解説してる通り、反対符号同士で引き合います。
そのため、生成されたイオン同士は引き合って結合するはずなんです。
これを「イオン結合」といいます。
シミュレーターで確認しよう!:NaとClのイオン結合
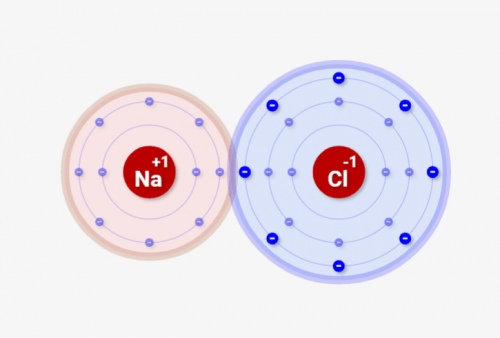
↓の例では先程と同じNaとClの例ですが、イオンができた後に、プラスとマイナスの電荷として互いに引き合います。
↓「実行」ボタンを押してみてください!
結果としてシミュレーターの結果の通り、↓のようにNaとClは結合するわけです!
イオン結晶 = イオン結合でマイナスイオンとプラスイオンが交互に結合した決勝
↑のように、イオン化することにより各原子は電荷(電気)を帯び、結合します。
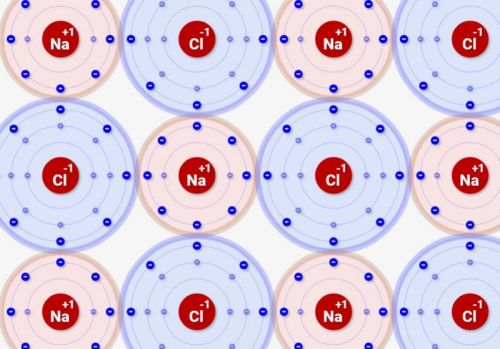
しかし、2つだけ結合するに留まりません。マイナスイオンは周囲にプラスイオンを吸引し、プラスイオンはマイナスイオンを呼び寄せます。
その結果、プラスイオンとマイナスイオンが交互に結合した物体ができあがります。これを「イオン結晶」といいます!
シミュレーターで確認しよう!:NaとClのイオン結合
↓の例では先程と同じNaとClの例です。2つのイオンがそれぞれイオンを呼び寄せ、連鎖的に結晶していく様が観察できます!
↓「実行」ボタンを押してみてください!
実行してみると、最終的に↓のように交互にNaとClのイオンが結合していくのが分かります、これが「イオン結晶」です!
まとめ:オクテット則を満たすため電子の受渡し⇒イオン化⇒電荷により交互に結合して結晶化
今回はイオン結合について解説しました。イオンは「一つ電子が足りない原子」と「一つ電子が余剰な原子」で電子を受け渡されることによって発生します。オクテット則を満たすために、電子を受け渡しがおきると、原子としては安定しますが、電荷を帯びるわけです。
さらにその電荷によって、2つのイオンは結合します。これがイオン結合です。
そして連鎖的に周囲にイオンを呼び寄せていき、、、、イオン結晶が作られるわけです!

次回は、別の化学結合である共有結合について解説します!
- 「一つ電子が足りない原子」と「一つ電子が余剰な原子」が電子の受け渡しを行う
- イオン化すると、電子が通常原子よりも多くなったり少なくなったたりするためイオン化する
- それによって互いにイオンは結合し合い、最終的にイオン結晶をつくる
⇒「化学結合」カテゴリ記事一覧
その他関連カテゴリ