「共有結合」の原理をシミュレーターで理解しよう![化学入門]
前回までの記事で、化学の原子についての解説をしてきました。今回からはそれを用いて「化学結合」について解説していきます!
本記事では「共有結合」を解説していきます!
![「共有結合」の原理をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220504170113-500x332.png)
目次
おさらい:オクテット則 = 安定的な価電子の個数があるという法則
上記のように価電子は求められるのですが、原子の動きを決める中で重大な法則がありました。それがこの「オクテット則」です。
原子というのは不安定で、安定的でないと何らかの化学反応を起こして他原子と結合を起こしたりします。その安定性を決めるのがこの「オクテット則」です。
具体的にいうと↓のような動きになります。
- 価電子は、「その電子軌道が満員」or 「価電子8個」になったときに安定となる
- それ以外の場合、電子を排出したり、逆に吸引したりして、その状態になろうとする
例えば、Neは↓のように価電子が8となります。そのため、非常に安定的な元素です。

それに対して、Fは↓のように価電子が7です。そのため、価電子を8にしようと「電子を他から吸引して取り込む」ような力が働きます。

逆にNaは↓のように価電子が1です。この場合、1個電子が余分なので逆に「電子を排出する」ような力が働きます。

このように、「価電子の数が、安定的な8と比べて多いか少ないか」によって、動きが変わるんです!これによって元素の性質が決まってくるため、「同じ価電子の原子は同じような動きをする」といえるんです。
共有結合 = 2つの原子が電子を共有することでオクテット則を満たそうとする結合
前回の記事では「電子が余分にあるもの、不足してるもの同士で電子を受け渡す」イオン結合について説明しました。電子を受け渡しすることで、オクテット則を満たそうとするのです。
しかし、共有結合では少し無理やりな方法でオクテット則を満たそうとします。その方法は↓の通りです。
2つの原子から1つずつ電子をもってきて「共有のもの」とし、両原子で電子を2つもっているものとみなす
例えばフッ素原子は↓のように価電子7で不安定なのですが、

2つのフッ素原子が共有結合すると、↓のようになります。黄色部分が共有結合です。

このように共有結合すると「黄色部分は両方の原子共有であり、両方の価電子とみなす」ようになるわけです。
そのように数えると、、、両方のフッ素で価電子が8になり、安定するんです!なんだかズルいようにみえますが、実際このような共有結合の形をとると電子が安定するんです。
3つの共有結合
↑が共有結合の原理ですが、これには3つのタイプがあります。それぞれシミュレーターを用いて解説していきます!
単結合(一重結合)
単結合は「2つの原子から1つの共有結合をつくるもの」です。↑のフッ素の例も単結合です。
今度は2つの水素の例で単結合をシミュレーターで確認してみましょう!
水素の場合、K殻の最大に入る電子が2なので、1つの共有結合をつくることで原子が安定となります。
↓「実行」ボタンを押してみてください!
↓の状態になると、各水素が価電子2とみなされ、安定するわけです。

二重結合 = 2ペアの共有結合
二重結合は「2つの原子から2つの共有結合をつくるもの」です。電子が2つ不足している場合、1つの共有結合では足りません。そのため、2つの電子を提供しあって、4つの電子を共有物とみなすんです!
今回は酸素原子2つの例でシミュレーション確認してみます!
↓「実行」ボタンを押してみてください!
二重結合は↓のようになります。共有結合が2ペアあるイメージで、黄色部分が4電子存在とみなされます。そうすると、各酸素原子が8つの価電子をもってると見なせるんですね。

三重結合 = 3ペアの共有結合
三重結合は「2つの原子から3つの共有結合をつくるもの」です。二重結合と考え方は同じです。電子が3つ不足している場合、1つの共有結合では足りません。そのため、3つの電子を提供しあって、6つの電子を共有物とみなすんです!
今回は窒素原子2つの例でシミュレーション確認してみます!
↓「実行」ボタンを押してみてください!
三重結合は↓のようになります。共有結合が3ペアあるイメージで、黄色部分が6電子存在とみなされます。そうすると、各窒素原子が8つの価電子をもってると見なせ、安定するんです!
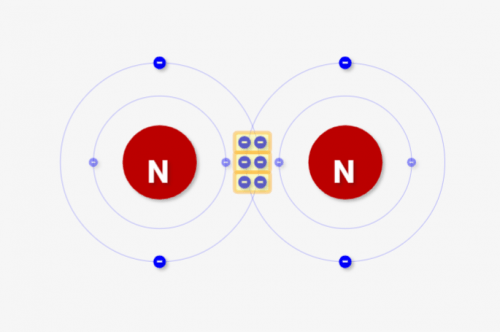
まとめ:2原子は共有結合して、安定化させる結合!
今回は共有結合について解説しました。共有結合は「2つの原子の共有物とみなす電子ペアをつくる」ことによる結合です。そうすると、↓のようになり、両原子で2電子とカウントできるようになるわけです。
こうなると、価電子が足りない場合でも、無理やり「価電子=8」と見なせるわけです!

今回紹介した「\(H_2\)」「\(O_2\)」「\(N_2\)」はその典型で、空気中にも多く存在しているものなんです!それぐらい共有結合は重要でよくでてくるものなんです。
今回は基礎的な二原子での共有結合の例について解説しました。次回記事では、三原子以上の例で解説します!
2つの原子から1つずつ電子をもってきて「共有のもの」とし、両原子で電子を2つもっているものとみなす。これを共有結合という
⇒「化学結合」カテゴリ記事一覧
その他関連カテゴリ