「水素結合」をシミュレーターで理解しよう![化学入門]
前回までの記事で、化学結合の「共有結合」「電気陰性度」についての解説をしてきました。今回からはそれを用いて「水素結合」について解説していきます!
本記事では「共有結合による分子」「原子価」を解説していきます!
![「水素結合」をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220508103846b-500x221.png)
目次
おさらい:共有結合 = 2つの原子が電子を共有することでオクテット則を満たそうとする結合
共有結合とは
前回の記事では「電子が余分にあるもの、不足してるもの同士で電子を受け渡す」イオン結合について説明しました。電子を受け渡しすることで、オクテット則を満たそうとするのです。
しかし、共有結合では少し無理やりな方法でオクテット則を満たそうとします。その方法は↓の通りです。
2つの原子から1つずつ電子をもってきて「共有のもの」とし、両原子で電子を2つもっているものとみなす
例えばフッ素原子は↓のように価電子7で不安定なのですが、

2つのフッ素原子が共有結合すると、↓のようになります。黄色部分が共有結合です。

このように共有結合すると「黄色部分は両方の原子共有であり、両方の価電子とみなす」ようになるわけです。
そのように数えると、、、両方のフッ素で価電子が8になり、安定するんです!なんだかズルいようにみえますが、実際このような共有結合の形をとると電子が安定するんです。
電気陰性度 = 共有結合電子を引っ張る力
上記の共有結合に対して、電気陰性度というものがあります。
共有結合したときに、自分の原子核に共有電子を引っ張ろうとする力
実は、共有結合をしたときに、共有電子は必ずしも二原子の真ん中にあるわけではないんです!
原子ごとに「電気陰性度」があって、その強さの大小によって、「どっちの原子よりに共有電子が配置されるか」が決まります。そして共有電子が近いほど、マイナス電荷を帯びます。逆に共有電子を奪われた側は、プラス電荷を帯びていきます。
それゆえに、「同じ分子内でもマイナス電荷に偏った部分と、プラス電荷に偏った部分」が出てくるんです!
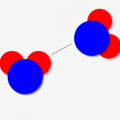
シミュレーター:水分子\(H_2O\)での例
水分子を例にとると↓のような感じです。「酸素の電気陰性度 > 水素の電気陰性度」のため、黄色枠で示す共有電子が酸素側に引き寄せられます。
そしてその結果、酸素原子がマイナス、水素原子がマイナスに電荷を帯びるんです!
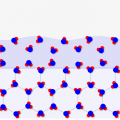
↓「実行」ボタンを押してみてください!
* 赤色がプラス電荷、青色がマイナス電荷に帯びていることを示しています
シミュレーターを動かしてみると、↓のように電気的に偏りがでるのが分かると思います!

水素結合 = 分子内の電気的な偏りによる結合
上記のように、水素が入っていると、↑のように分子内でも電気的な偏りが発生しやすいです。
すると、「電荷はプラスとマイナスで引き合う(クーロン力)」ので、↓の線のように互いの水素原子(赤)と酸素原子(青)が引き合うんです!これを「水素結合」といいます。
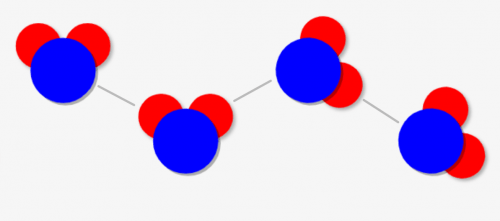
水素結合の主な例は水分子ですが、その他にも水素原子は電気陰性度が発生します。電気陰性度の差がある「H-F」「H-O」「H-N」などが分子に含まれる場合に置きます。フッ化水素\(HF\)やアンモニア\(NH_3\)がその例になります!
水素結合をシミュレータで確認してみよう!
上記で解説した水素結合が発生するため、実は水分子は互いに結合して、特定の形を作って固定的に結合していきます。これが、氷が固まる原理です。
この動きをシミュレーターで確認してみましょう!
↓の切り替えボタンを押すと、水分子が結合して固定化されたり、元に戻ったりします!
シミュレーターを動かすと、↓のように水分子が固定化されるのがわかると思います。また、よくみると「酸素原子(青)」と「水素原子(赤)」が互いに結びあって結合しているのが分かると思います。
これが水素結合の力であり、氷として固まった状態です!

水素結合があるからこそ、水分子は色んな性質を持つ!
今回は「水素結合」について解説していきました。水素結合は、「共有結合電子が電気陰性度によって、特定の原子に引き寄せられる」ことから電気的偏りが発生することで現れる結合です。
水素結合の最たる例は水分子です。この水素結合が顕著にでるからこそ、水分子は氷/水/水蒸気という形態になり、様々な特殊な性質が出てくるんです!
この「氷/水/水蒸気」については、「物質の状態変化」のカテゴリーで詳しく解説していきます!
- 水素結合は、電気陰性度の差が大きな二原子が共有結合したときに電子が偏ることによって発生する電気的な力
- 水の場合、酸素がマイナス、水素がプラスの電荷を帯びる。それにより、酸素 – 水素が互いに比寄せ合う
- この水素結合があるため、水は他の物質とは違う変わった性質をいくつか持つ
⇒「化学結合」カテゴリ記事一覧
その他関連カテゴリ