「電気陰性度」をシミュレーターで理解しよう![化学入門]
前回までの記事で、化学の原子についての解説をしてきました。今回からはそれを用いて「化学結合」について解説していきます!
本記事では「共有結合による分子」「原子価」を解説していきます!
![「電気陰性度」をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220504230806-1-500x355.png)
目次
おさらい:共有結合 = 2つの原子が電子を共有することでオクテット則を満たそうとする結合
前回の記事では「電子が余分にあるもの、不足してるもの同士で電子を受け渡す」イオン結合について説明しました。電子を受け渡しすることで、オクテット則を満たそうとするのです。
しかし、共有結合では少し無理やりな方法でオクテット則を満たそうとします。その方法は↓の通りです。
2つの原子から1つずつ電子をもってきて「共有のもの」とし、両原子で電子を2つもっているものとみなす
例えばフッ素原子は↓のように価電子7で不安定なのですが、

2つのフッ素原子が共有結合すると、↓のようになります。黄色部分が共有結合です。

このように共有結合すると「黄色部分は両方の原子共有であり、両方の価電子とみなす」ようになるわけです。
そのように数えると、、、両方のフッ素で価電子が8になり、安定するんです!なんだかズルいようにみえますが、実際このような共有結合の形をとると電子が安定するんです。
電気陰性度 = 共有結合電子を引っ張る力
上記の共有結合の考え方を前提に、「電気陰性度」を解説していきます!
電気陰性度の定義
電気陰性度の定義は↓の通りです
共有結合したときに、自分の原子核に共有電子を引っ張ろうとする力
実は、共有結合をしたときに、共有電子は必ずしも二原子の真ん中にあるわけではないんです!
原子ごとに「電気陰性度」があって、その強さの大小によって、「どっちの原子よりに共有電子が配置されるか」が決まります。そして共有電子が近いほど、マイナス電荷を帯びます。逆に共有電子を奪われた側は、プラス電荷を帯びていきます。
それゆえに、「同じ分子内でもマイナス電荷に偏った部分と、プラス電荷に偏った部分」が出てくるんです!
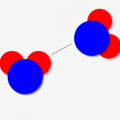
シミュレーター:水分子\(H_2O\)での例
水分子を例にとると↓のような感じです。「酸素の電気陰性度 > 水素の電気陰性度」のため、黄色枠で示す共有電子が酸素側に引き寄せられます。
そしてその結果、酸素原子がマイナス、水素原子がマイナスに電荷を帯びるんです!
↓「実行」ボタンを押してみてください!
* 赤色がプラス電荷、青色がマイナス電荷に帯びていることを示しています
シミュレーターを動かしてみると、↓のように共有電子が酸素型に寄っているのがわかると思います。

電気陰性度グラフ
電気陰性度は原子ごとに違った値を持ちます。基本的に、↓図のように「周期表の右上にいくほど強い電気陰性度を持つ」という傾向があります。(貴ガスは除く)
そのため元素の中でフッ素が最大の電気陰性度を持つことになります。

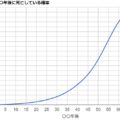
実際の数値を、元素番号順にグラフ化すると↓のようになります。横軸が原子番号順に原子を並べたもので、縦軸が電気陰性度です。これを見ると「原子番号が小さいほど電気陰性度は高めになる」「同じ周期ならば右にいくほど電気陰性度が高い」ということが分かると思います!

電気陰性度が右上(フッ素)が最大になる要因
ここでは、「電気陰性度が周期表の右上にいくほど高い理由」「フッ素の電気陰性度が一番高くなる理由」を考えていきます!
大前提として↓のクーロン力を踏まえて考えていきます。これは物理記事でも解説していますが、2つの電荷\(q_1\),\(q_2\)があるときに互いにもたらす力を定式化したものです。
簡単にいえば、「電荷が大きいほど力が強い」「電荷が離れるほど力は急激に弱くなる」という性質があります。
\( \displaystyle \large{F = k \frac{|q_1||q_2|}{r^{2}}} \)
- \(q_1\),\(q_2\) : 電荷1,2の電気量[C]
- \(r\) : 2電荷間の距離[m]
- \(k\) : 比例係数で、真空中で\(9.0 × 10^9\)
要因1:同じ電子殻(軌道)なら、プラス電荷の大きい右側のほうが電気陰性度が高い
周期表の横の行が同じなら、最外殻電子殻の軌道も同じになります。とすると距離は一定なんです。
そうすると、「同じ行なら電荷が大きいものが、クーロン力が大きくなる」といえます。そのため、右に行くほど電気陰性度は大きくなります!
要因2:原子核に軌道が近いほど、プラス電荷による力を受ける
これは、↑のクーロン力の定義にあてはめれば分かりますね。原子核から距離が離れるほど、クーロン力は小さくなります。
確かに周期表で下にいくほど電荷は大きくなりますが、それ以上に距離が離れることによって力が減少する度合いのほうが大きいのです!
要因3: 貴(希)ガスは共有電子を持たないので、電気陰性度は定義されない
なぜ右上にいくほど電気陰性度が高くなるのに、貴ガス(18族)が最大にならないか。それは「貴(希)ガスは共有電子をもった共有結合を持たない」からです。
貴ガスはもとの状態でオクテット則を満たされているので、わざわざ共有結合を持ちません。なので、電気陰性度も定義されないわけです!
まとめ:共有結合は電気陰性度の高いほうに引き寄せられ、電荷似方よりが発生する!
今回は電気陰性度について解説しました。共有結合において、その共有電子が二原子の真ん中に必ずくるというわけではありません。実際は原子同士の「電気陰性度=電子を引き寄せる強さ」によって引っ張り合いをします。
その結果、↓の水分子のように力が強い酸素(O)のほうに共有電子が引き寄せられ、酸素がマイナス電荷に帯びるようになります。逆に共有電子を奪われた水素(H)はプラス電荷を帯びます。

この偏りは、「二原子電気陰性度の差」が大きいほど強く発生するわけです。次回はこの電気の偏りを応用して、「水素結合」を解説していきます!
- 電気陰性度 = 共有結合したときに、自分の原子核に共有電子を引っ張ろうとする力
- さらに電気陰性度の差が大きいと、分子内でもプラスの電荷に帯びる原子とマイナス電荷に帯びる原子が現れてくる
- それによって、分子間の結合力などが現れる
⇒「化学結合」カテゴリ記事一覧
その他関連カテゴリ