「共有結合による分子構成」「原子価」をシミュレーターで理解しよう![化学入門]
前回までの記事で、化学の原子についての解説をしてきました。今回からはそれを用いて「化学結合」について解説していきます!
本記事では「共有結合による分子」「原子価」を解説していきます!
![「共有結合による分子構成」「原子価」をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220504185630-1-500x495.png)
目次
おさらい:共有結合 = 2つの原子が電子を共有することでオクテット則を満たそうとする結合
前回の記事では「電子が余分にあるもの、不足してるもの同士で電子を受け渡す」イオン結合について説明しました。電子を受け渡しすることで、オクテット則を満たそうとするのです。
しかし、共有結合では少し無理やりな方法でオクテット則を満たそうとします。その方法は↓の通りです。
2つの原子から1つずつ電子をもってきて「共有のもの」とし、両原子で電子を2つもっているものとみなす
例えばフッ素原子は↓のように価電子7で不安定なのですが、

2つのフッ素原子が共有結合すると、↓のようになります。黄色部分が共有結合です。

このように共有結合すると「黄色部分は両方の原子共有であり、両方の価電子とみなす」ようになるわけです。
そのように数えると、、、両方のフッ素で価電子が8になり、安定するんです!なんだかズルいようにみえますが、実際このような共有結合の形をとると電子が安定するんです。
共有結合による分子構成
前回記事では、単純に二原子の共有結合の例で示しました。しかし、実際の世界では共有結合が色んなところで使われており、この共有結合で多くの原子が結合して大きな分子を作ることも多いんです!
今回は代表的な分子の「水\(H_2O\)」「メタン\(CH_4\)」「二酸化炭素\(CO_2\)」の結合をシミュレーターで示します!
水\(H_2O\)の共有結合
酸素Oは価電子6であり、オクテット則を満たすためには2個電子が足りません。逆に言うと、2つの共有結合のペアを持つことが出来るということなんです!
そのため、この酸素Oは、水素原子H 2つと共有結合することで安定させることが出来ます。水素原子1つは共有結合を1ペア作ることができるからです。これが\(H_2O\)と呼ばれる水分子です!
↓のシミュレーターで\(H_2O\)が構成される様子を確認できます!
↓「実行」ボタンを押してみてください!
実行してみると、↓のような分子が構成できます。これが\(H_2O\)つまり水分子です!
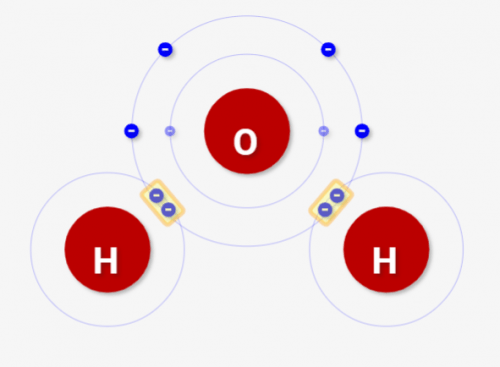
メタン\(CH_4\)の共有結合
炭素Cは価電子4であり、オクテット則を満たすためには4個電子が足りません。逆に言うと、4つの共有結合のペアを持つことが出来るということなんです。酸素Oよりも多くの共有結合が持てるということです。
炭素原子1つあたり、4つの共有結合をつくり、様々な化合物を作ることができます。メタン\(CH_4\)は一番カンタンな例になります。
↓のシミュレーターで\(CH_4\)が構成される様子を確認できます!
↓「実行」ボタンを押してみてください!
実行してみると、↓のような分子が構成できます。これがメタン\(CH_4\)です!炭素はこのように「4つの接続口を持つ元素」なんです。だからこそ、非常に多くの原子と結合して、多くの化合物を生成できるんです!(炭素はその反応の多さから、元素の王様とも言われています)
二酸化炭素\(CO_2\)の共有結合
上記の通り、炭素Cは4つの共有結合、酸素は2つの共有結合が作れます。そのため、炭素Cは、2つの酸素Oと二重結合でつながる事ができるのです!
炭素Cには4つの接続できる腕があるので、二本の腕を持つ酸素Oが2つ出来るというイメージです!
↓のシミュレーターで\(CO_2\)が構成される様子を確認できます!
↓「実行」ボタンを押してみてください!
実行してみると、↓のような分子が構成できます。これが二酸化炭素\(CO_2\)です!両方とも二重結合で、全部で4ペアの共有結合が出来ているのが分かります。

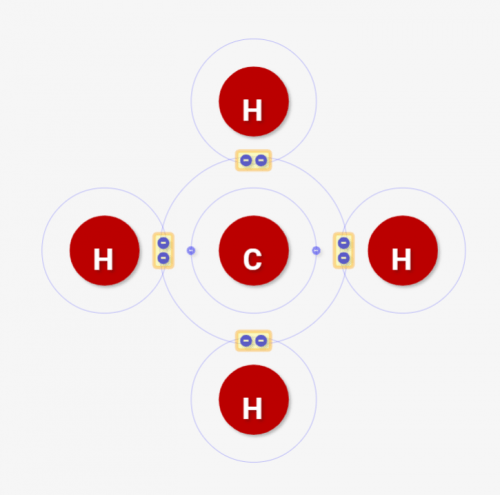
「何個の共有結合ができるか」=「腕の数」=「原子価」
↑で示してきたように、酸素Oは2つ、炭素は4つの共有結合が作れます。他の原子と接続出来る数が違うんですね。
化学ではこのように接続できる数を「腕」と表現することが多いです。↓の例でいうと、炭素は4つの腕(共有結合)を持っているとみなせます。
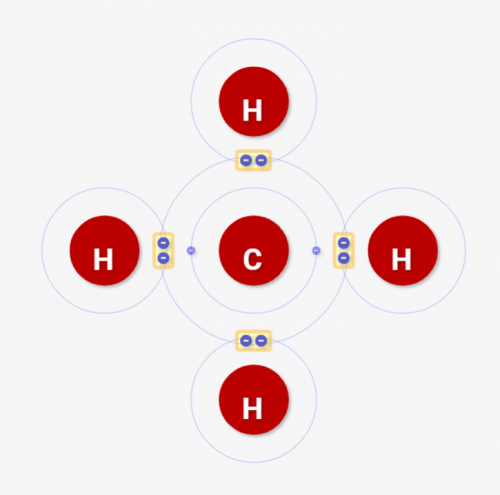
このように「何個の共有結合を持てる腕があるか」を「原子価」と呼びます。
シミュレーターの例でわかる通り、水素Hは原子価1、酸素Oは原子価2、炭素Cは原子価4となります。だから、炭素C 1つに対して、水素は4つ、酸素2つ結合できるわけです。
原子価を見れば、互いの元素が何個接続できそうかが分かるんですね!
まとめ:共有結合によって様々な分子が構成される!
今回は共有結合による分子構成の例を説明しました。元素ごとに価電子が違うので、何個の共有結合が出来るかがきまっています。これを「原子価」といいます。
原子価が4と高い炭素Cは多くの元素と、結合ができます。ある意味で、炭素は「原子と原子を結合する接着剤」みたいな役割をしていきます。ここについては、「有機化合物」のカテゴリーで詳しく解説していきますが、今回の「何本の腕を持つか=原子価はいくつか」という考え方は非常に重要になります!覚えておきましょう!
- 原子によって何個の共有結合をつくれるかが違う。これは価電子によって決まる
- 価電子6の酸素は2つ、価電子4の炭素は4つの共有結合がつくれる
- 炭素は4つと多くの腕を持っているため、様々な元素と多くの化合物を作ることができる
⇒「化学結合」カテゴリ記事一覧
その他関連カテゴリ