「価電子」と「周期表」をシミュレーターで理解しよう![化学入門]
前回記事から化学の分野についての解説をしていきます。化学で一番の基礎といえるのが「原子」です。
本記事では「価電子」と「周期表」を解説していきます!
![「価電子」と「周期表」をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220430203628-500x483.png)
目次
おさらい:化学の基礎の基礎。原子とは?
原子とは、「この世界を構成する最小要素」です。地球にあるもの、宇宙にあるものの全てがこの「原子」で構成されます。
原子は↓の「陽子」「中性子」「電子」の3つで構成されます。
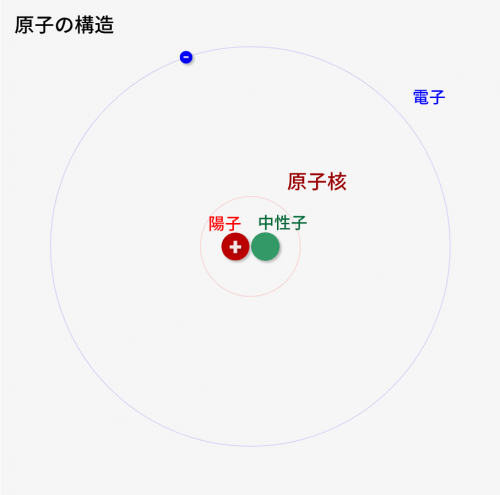
陽子
- 中性子とともに、中心(原子核)を構成する要素
- 中世子と同じ質量を持つ
- 電子とは真逆のプラスの電荷をもつ
中性子
- 陽子とともに、中心(原子核)を構成する要素
- 陽子と同じ質量を持つ
- 電荷をもたない
電子
- 原子核のまわりを回る要素
- 陽子とは真逆のマイナスの電荷を持つ
- 陽子/中性子と比べると小さく、質量がほとんどない
価電子 = 一番外側に配置される電子のこと
まず価電子について説明します。原子は種類によって様々な性質を持ちますが、そのような原子の性質は「一番外側の電子=最外殻にある電子」によって決まることが多いです。
この「最外殻にある電子」のことを「価電子」といいます!
原子の性質を決める「最外殻にある電子」のこと
例えば↓のマグネシウムの例では、M殻にある2個の電子が価電子になります!
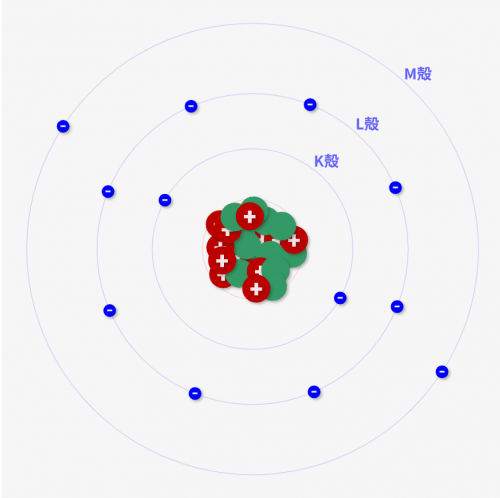
特にこの「価電子の数」が非常に重要なのです!
周期表 = 価電子の数で原子を分類した表
上記のとおり、原子の性質は「価電子の数」によって決まる傾向があります。そこで、化学では↓のような「周期表」を用いて、原子を分類します。
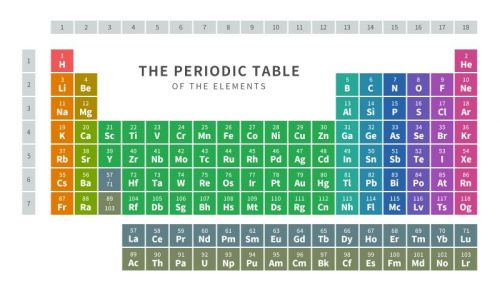
周期表は「価電子が同じものは、同じ列になるように分類した表」です。
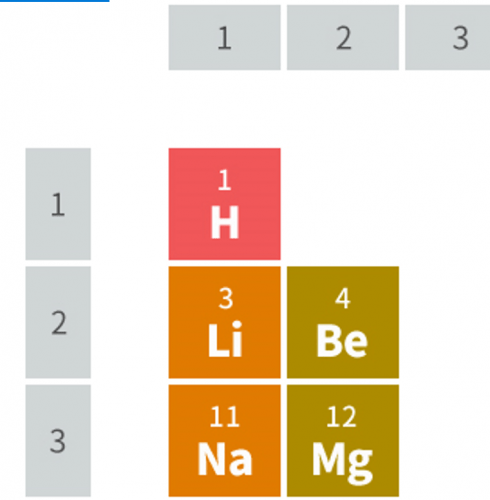
このときに、縦の列を「族」、横の行を「周期」と呼びます。例えば、↓のMgは3周期目の2族の原子ということになります。
それではここで、実際に「価電子」と「周期表」関係性はどうなるのか、シミュレーターで見てみましょう!
「価電子」と「周期表」をシミュレーターで計算してみよう!
- ↓のスライドバーで原子番号を選択すると、↓で「価電子」の配置と「周期表上の位置」が確認できます
- 周期表では、現在選択している原子を緑背景で表示します
- 今回のシミュレーターでは、原子番号20のCaまでが表示可能です
- 電子殻の中で、電子が入る空きがある場所は灰色で示しています
* 正確には3周期目と4周期目の電子殻にはもっと入りますが、今回8個だけ電子が入る枠があるものとして表現しています。
縦の列で「族」、横の行で「周期」を表しています。
周期表の規則
↑のシミュレーターから、次のような性質が見えてくると思います。
同じ周期上では、族が大きくなっていくほど価電子が多くなる
これはシミュレーターで原子番号を増加させてみるとわかると思います。同じ行ならば、右にいくほど電子が埋まっていきます。
(ただし、今回除外している3族~12族は、遷移元素といってこの限りではないです)
1,2,13~18族は、「下一桁の数 = 価電子の数」となる
これも観察すると分かると思います。今回シミュレーターで表示している1,2,13~18族は、その族の下一桁の数だけ価電子を持ちます。
例えば原子番号8の酸素は、16族となりますが、ちょうど6個の価電子を持ちます。
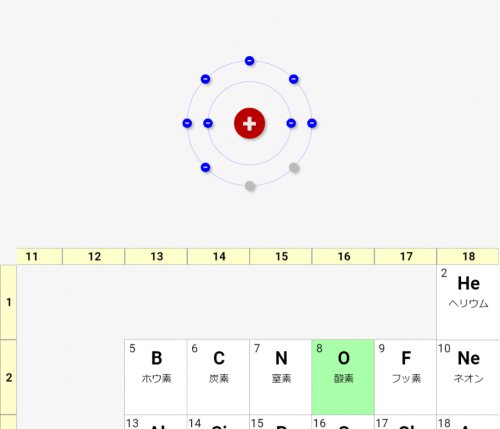
周期が増えて、次の行にいくと電子殻の軌道が増える
シミュレーターで分かる通り、各原子の災害殻は、1行目のときはK殻、2行目はときはL殻、3行目のときはM殻、4行目はN殻というように増えていきます。
つまり、周期の行数を見れば、どの軌道が最外殻になるかが分かるんです!
↓4周期目のCaは、最外殻が4番目のN殻となることが分かります
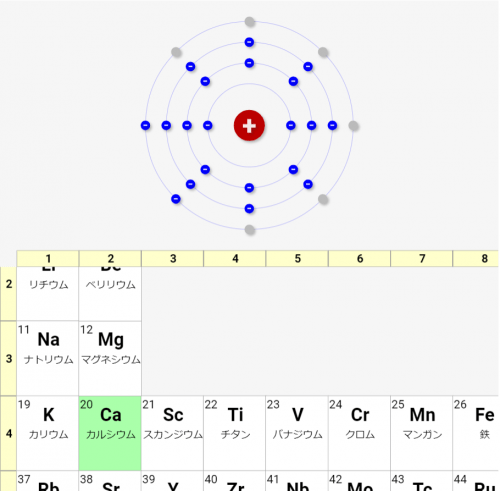
まとめ:一番外側電子殻の電子を「価電子」といい、その数で分類して「周期表」をつくる!
今回は「価電子」について解説しました。価電子は原子の性質を決める「最外殻にある電子」のことを意味します。原子の性質を決める一番の要素は、この価電子の数になります。
そのため、この価電子の数で原子を分類した表を「周期表」といいます。このときに、縦の列を「族」、横の行を「周期」と呼びます。
そして同じ周期ならば、族が増えて右にいくほど価電子が大きくなっていきます。
特に「族」は重要です。1,2,13~18族では「族の下一桁の数 = 価電子の数」という重要な決めがあります!このルールで原子を整理して分類していることを理解しましょう!
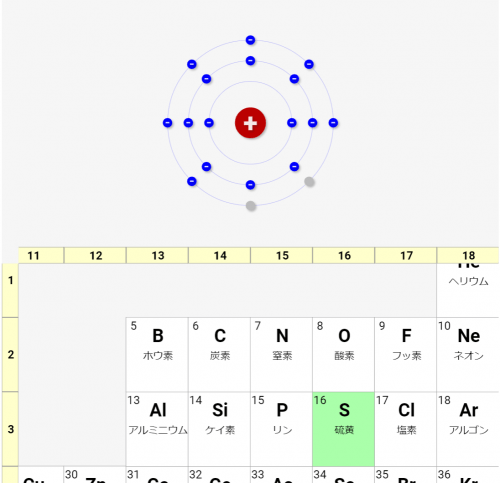
- 一番外側にある軌道(最外殻)にある電子の数は、原子の性質を決める重要な役割を持つ。この最外殻の電子を、価電子という
- この最外殻軌道と価電子の数でうまく分類したのが、化学の周期表。縦の列を「族」、横の行を「周期」と呼ぶ
⇒「元素の構成」カテゴリ記事一覧
その他関連カテゴリ