原子の陽子数/中性子数/電子数による変化をシミュレーターで理解しよう![化学入門]
前回記事から化学の分野についての解説をしていきます。化学で一番の基礎といえるのが「原子」です。
本記事では前回記事につづいて「原子の構造」を解説していきます!
![原子の陽子数/中性子数/電子数による変化をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220427002418-500x500.png)
目次
おさらい:化学の基礎の基礎。原子とは?
原子とは、「この世界を構成する最小要素」です。地球にあるもの、宇宙にあるものの全てがこの「原子」で構成されます。
原子は↓の「陽子」「中性子」「電子」の3つで構成されます。
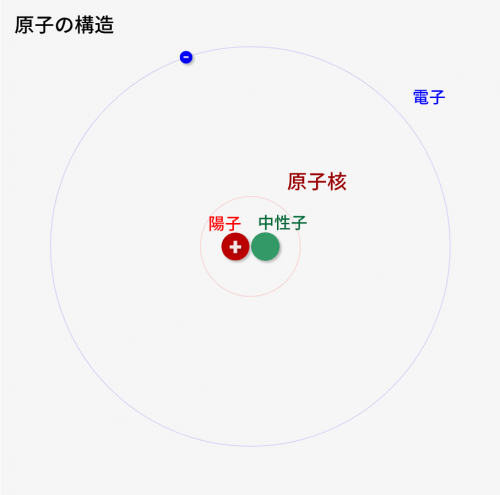
陽子
- 中性子とともに、中心(原子核)を構成する要素
- 中世子と同じ質量を持つ
- 電子とは真逆のプラスの電荷をもつ
中性子
- 陽子とともに、中心(原子核)を構成する要素
- 陽子と同じ質量を持つ
- 電荷をもたない
電子
- 原子核のまわりを回る要素
- 陽子とは真逆のマイナスの電荷を持つ
- 陽子/中性子と比べると小さく、質量がほとんどない
原子の構成要素の性質まとめ
↑の「質量」「電荷(電気)」の観点を表にまとめると、↓のようになります。
結局、原子の質量/電荷はそれぞれの要素の足し算で決まるわけです!
| 質量 | 電荷 | |
|---|---|---|
| 陽子 | +1 | +1 |
| 中性子 | +1 | 0 |
| 電子 | 0 | -1 |
*正確には電子も質量はあるが0に限りなく近い値となる
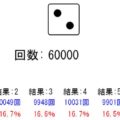
原子の陽子数/中性子数/電子数による変化をシミュレーターを確認してみよう!
陽子/中性子/電子の組み合わせで、原子がどのような質量/電荷になるのか、シミュレーターで確認してみましょう!
シミュレーターの説明
- スライドバーによって陽子数/中性子数/電子数が変えられます
- 指定された個数をもとに、原子のアニメーションが描かれます
- 同時に計算した質量/電荷と原子番号が表示されます
- 原子番号=陽子数によって、原子種類が変わることを確認しましょう
質量 : 0
電荷 : 0
原子番号 1
赤で陽子、緑で中性子、青で電子を示しています。
原子の性質
原子番号(原子の種類)は陽子数で決まる
前回も解説したとおり、元素の種類は元素番号=陽子の数で決まります。
陽子数=電子数のとき、電荷が±0になる
これも当たり前ですね。陽子が+1、電子が-1の電荷をもつので、その数が等しいときに電荷が0になります。
これが、元素の基本状態になります!
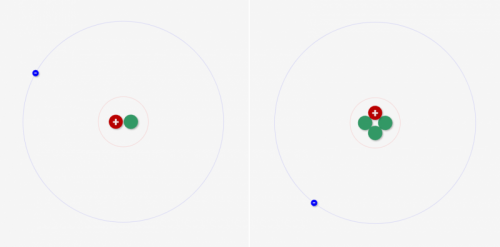
同じ基本元素状態でも、中性子数が違うものができる
「陽子数=電子数」が元素の基本状態ですが、同じ元素種類でも中性子数が異なるものがあることがわかります。
例えば水素の場合「陽子=電子=1」となるはずなんですが、中性子は1,2,3…と何種類もとれるんです。これを「同位体」といいます!(後記事で解説)
↓同じ水素の基本形でも、中性子の数が違うものができる
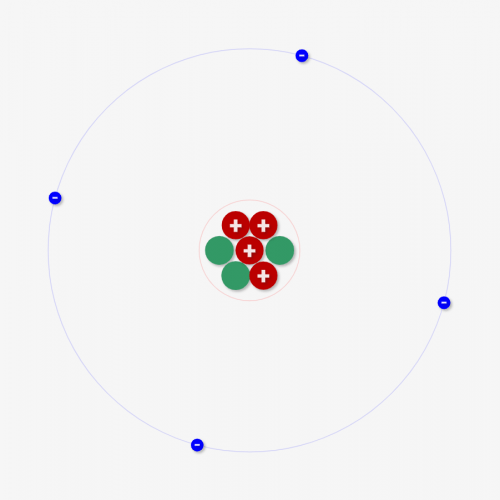
今回紹介したのはイメージモデル… 実際はもう少し原子は構造が違います!
↑のシミュレーターの通り、陽子数/中性子数/電子数により、どんな元素なのかが決まります。
今回は↓のような単純に「電子が原子核の周りを円でまわっている」モデルで表しましたが、実際はもう少し複雑です。同じ位置に電子が全て入るわけではないんです。このあたりのことを次回解説します!
「陽子数/中性子数/電子数」まとめ
- 原子はこの世のあらゆるものを構成する最小の要素
- 原子は「陽子」「中性子」「電子」の3つの要素で構成される
- 電荷は陽子数と電子数で決まり、質量は陽子と中性子数で決まる
[関連記事] 原子の基礎
⇒「元素の構成」カテゴリ記事一覧
その他関連カテゴリ