電子殻(K殻,L殻,M殻…)をシミュレーターで理解しよう![化学入門]
前回記事から化学の分野についての解説をしていきます。化学で一番の基礎といえるのが「原子」です。
本記事では「電子殻」を解説していきます!
![電子殻(K殻,L殻,M殻…)をシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220427211924-500x497.png)
目次
おさらい:化学の基礎の基礎。原子とは?
原子とは、「この世界を構成する最小要素」です。地球にあるもの、宇宙にあるものの全てがこの「原子」で構成されます。
原子は↓の「陽子」「中性子」「電子」の3つで構成されます。
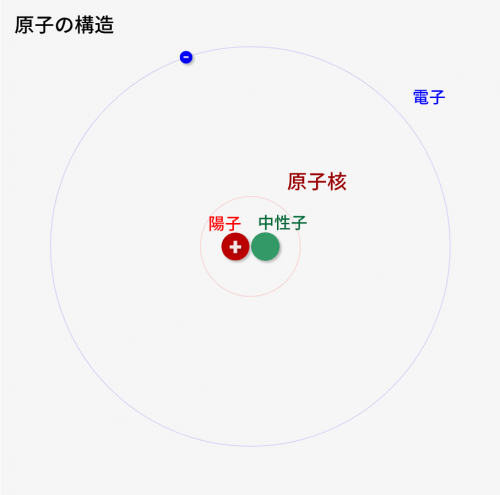
陽子
- 中性子とともに、中心(原子核)を構成する要素
- 中世子と同じ質量を持つ
- 電子とは真逆のプラスの電荷をもつ
中性子
- 陽子とともに、中心(原子核)を構成する要素
- 陽子と同じ質量を持つ
- 電荷をもたない
電子
- 原子核のまわりを回る要素
- 陽子とは真逆のマイナスの電荷を持つ
- 陽子/中性子と比べると小さく、質量がほとんどない
まとめると↓のようになります。
| 質量 | 電荷 | |
|---|---|---|
| 陽子 | +1 | +1 |
| 中性子 | +1 | 0 |
| 電子 | 0 | -1 |
*正確には電子も質量はあるが0に限りなく近い値となる
電子殻とは?
電子殻とは「電子が周回する経路の集まり」のことです。前回のシミュレーターでは全ての電子は同じ経路を回っているようなイメージで解説しました。
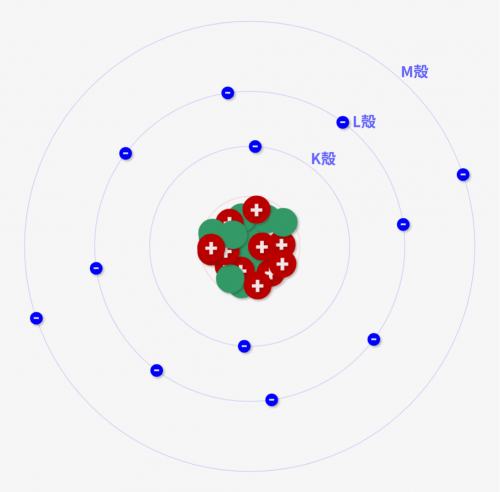
しかし、実際は↓のように電子ごとに回れる軌道(円)が決まっているんです!この円を「電子軌道」といいます。

各円は内側から「K殻」「L殻」「M殻」と呼びます。各殻は、定員数があり、入れる電子数が決まっているんです。その様子をシミュレーターで確認してみましょう!
電子殻(K殻,L殻,M殻)をシミュレーターを確認してみよう!
電子殻(K殻,L殻,M殻)にどのように電子が入っていくのか、シミュレーターで確認してみましょう!
- スライドバーによって原子番号(陽子数)が変えられます
- 原子は「陽子数=電子数」という定常状態になります
- 陽子数(=電子数)が増えると、各殻の電子数がどう変わるか確認してみましょう!
赤で陽子、緑で中性子、青で電子を示しています。
電子殻の重要事項
K殻に2個、L殻に8個、M殻に16個の電子が入る
今回のシミュレーターでは陽子数=電子数18のアルゴンまでしか確認できませんでしたが、実際には
の電子が入れられるようになっています。殻によって、入れる数が違うんです。一般法則でいうと、K殻を1番目,L殻を2番目と数えた時には↓のように定員数を定義できます。二次関数的に定員が大きくなっていきます。
(基本は)内側の殻から入っていき、いっぱいになったら次の殻が使われる
今回のシミュレーターで観察すると分かるとおり、「電子は内側のK殻から入っていく」動きになります。そしてK殻がいっぱいになったらL殻、それがうまったらM殻と埋まっていきます。
↓先に内側の殻が使われる
ただし、原子番号が大きくなっていくと、先に外側の殻の軌道に電子が入るという逆転も発生します。
K殻,L殻,M殻の後に、N殻、O殻、P殻もある
今回は一般的な高校の範囲で使われるM殻まででシミュレートしましたが、実際にはM殻の後にN殻、O殻、P殻もあります。どんどん中心から離れていくので、その分大きな周回軌道になります。
まとめ:原子は何個かの電子軌道(周回円)をもっている!
今回解説したように、原子の電子は同じ個所を回っているわけではありません。実際は何個かの円(電子軌道)があり、それぞれに定員があります。これら全て合わせて「電子殻」と呼びます。
次回は元素の記号での表し方を説明します!
- 電子は何個かの軌道があり、内側からK殻,L殻,M殻…と呼ばれる
- それぞれの軌道には定員数があある
- 内側の軌道から電子は入っていき、それがいっぱいになったら次の軌道に配置される
⇒「元素の構成」カテゴリ記事一覧
その他関連カテゴリ