水の「状態図」と変化を解説!温度と気圧を変化させてシミュレーターで理解しよう![化学入門]
前回記事では、「固体」「液体」「気体」の各状態について解説しました。
今回は「状態図」をシミュレーターを解説します。「温度」と「気圧」を変化させて、水がどのように変化するか観察してみましょう!
![水の「状態図」と変化を解説!温度と気圧を変化させてシミュレーターで理解しよう![化学入門]](https://retu27.com/wp-content/uploads/20220511211425-500x484.png)
目次
おさらい:水分子の各状態
固体 = 水素結合等でガチガチに固まった状態
物質の温度が低い場合、分子は死んだように動かない状態になります。そうなると、水素結合やその他の力が強く働き、ガチガチに分子がくっついた状態になるんです。これこそが「固体」という状態なんです!
そして、この固体の状態は「分子が動いて出ていく力 < 互いの分子の結合力」の条件下で形成されます。
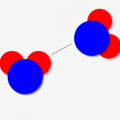
物質の状態2: 液体 = 完全な拘束状態からは抜け出したが、まだ分子間の力で引き寄せあっている状態
次に液体です。氷は0度になると、溶けて水になりますよね。これは「分子が動いて出ていく力 > 互いの分子の結合力」となり、その束縛から抜け出して動きだした状態と言えます!
ただ、完全に開放されたわけじゃないんです。水分子は互いに近いところをウロチョロと動き回れるようになりますが、互いの分子間で引き寄せ合う力が影響するので、完全に自由とはいえないような動きになります。
温度が高くなるほど、分子の動きが速くなっていき、その影響度合いが低くなってきます。

物質の状態3: 気体 = 互いの分子間の力から抜け出して、素早く動き回れる
次に気体です。水は100度になると、水蒸気に変わります。これは、「温度が高まって、水分子間の互いを結ぶ力から抜け出した状態」ともいえます。
液体状態では残っていた互いにくっつこうとする力から抜け出した、「自由な状態」になるわけです!完全ではないですが、力を受けない「等速運動」に近い動きになります!もちろん、温度が高まるとさらに高速に分子は動くようになります。

状態図とは?
前回記事でも簡単に解説しましたが、状態図についてまず説明します。
水は通常、0℃で氷から溶けて、100℃で蒸発します。しかし、実はこれは「気圧=1」という通常状態での常識でしか無いんです。気圧によって、氷が溶ける「融解点」と蒸発する「沸点」は大きく変わるんです!
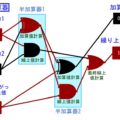
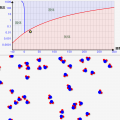
この「温度」と「気圧」による状態変化は↓の「状態図」で通常表されます。↓は水の状態図です。
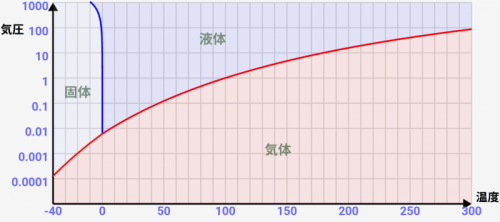
状態図は「横軸を温度、縦軸を気圧として、物質の状態がどうなるか表した図」です。気圧は、日常の環境を1としたものです。気圧2ならば、2倍の力で空気から押されるイメージです。縦軸は1メモリごとに気圧が10倍になっていることに注意して下さい。
この図をみると、何度で状態変化が起きるのかが一目瞭然です。確かに通常の1気圧では↓のように0℃と100℃で状態変化が起きることがわかりますが、
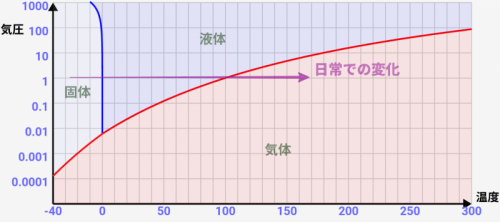
気圧がとてつもなく低い環境では↓のような変化になることが分かります。液体になることなく、固体から気体に昇華するんです!
この状態図を見れば、状態がどう変化するのかが分かるわけですね!
今回は「温度」と「気圧」を変化させて、状態変化を確認できるシミュレーターを用意してみました。コチラで実験をしてみましょう!
シミュレーターで氷/水/水蒸気での体積の差のイメージを掴んでみよう!
実際に、状態図のイメージを掴むために、シミュレーターで確認してみましょう!
- このシミュレーターは「温度」と「気圧」をスライドバーで変化させて、水の状態変化を確認できます
- 状態図の中で、現在の位置は黄色点で表示されます
- 気圧は、グラフ縦1目盛りごとに10倍されていて、大きく変化している事に注意して下さい。日常の気圧=1として表しています。
「状態図」変化の重要なポイント
低気圧では、液体にならない場合がある
これは↑でも解説している通りですね。↓のような非常に低い気圧では固体→気体という変化しか起きません。
ただし、0.001気圧=日常の1/1000倍気圧という、超低い気圧での現象と考えて下さい。日常ではまず発生しません。

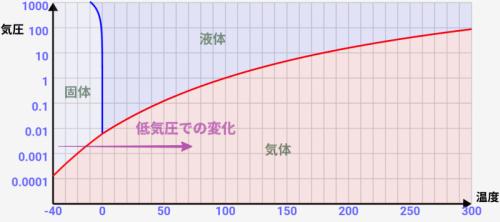
3つの状態が重なり合うポイントが一点だけある(3重点)
状態図を見ると、気体と固体と液体がちょうど重なり合うポイントが↓のようにあります。
この点を「三重点」と言います。
厳密にいうと、温度=0.01℃/気圧=0.006でこれが置きます。今回のシミュレーターでは厳密には表現できてないですが、実際はこの点になると「固体/液体/気体が混ざりあった状態」という特殊な状況になります。
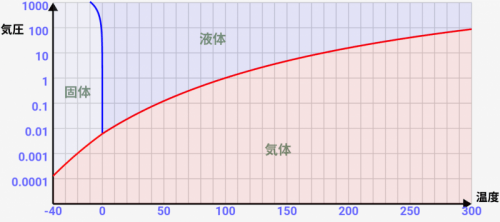
温度=-9~0℃あたりでは、気圧をあげていくと「気体→固体→液体」と変化していく
↓のような温度=-9~0℃辺りを見ると、高気圧下で固体から液体に変化するのがわかります。実際に低い気圧から変化させていくと「気体→固体→液体」と変化していくのが分かると思います。
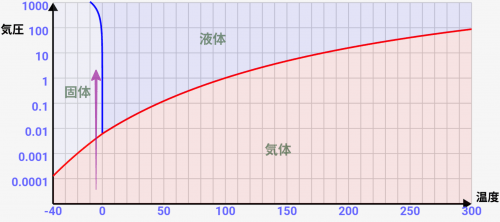
実はこれは水特有の特殊な現象です。通常は気圧を上げていくと、むしろ液体から固体に変化していく事が多いのです。
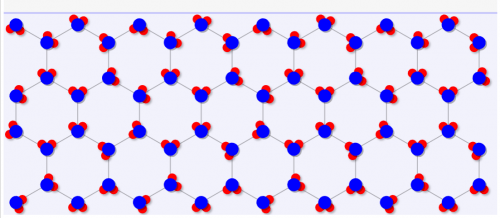
なぜ水は「気体→固体→液体」と変化するのかというと、「固体が水素結合により結晶を作るため、水よりも体積が大きい」からです。
水は↓のように特殊な結晶構造になるため、無駄に隙間が大きい構造になっているんです。
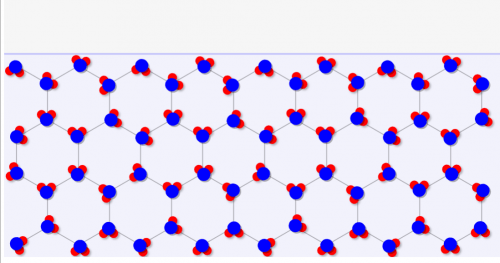
これに高圧を加えていくと、、、結晶がつぶされて↓のように少し体積が小さな液体(水)に変化します。余計な結晶を作らないので、水の場合は液体のほうが体積が低くなるんですね。
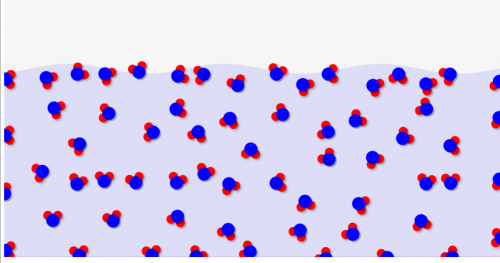
通常の物質はむしろ固体のほうが体積が小さくなるので、逆になるわけです。
このように水では特殊な変化になることを覚えておきましょう!
まとめ:状態図を見ると、非日常的な環境での真の状態変化が分かる!
今回は水を例にして、「状態図」について解説してみました。
状態図は↓のように横軸に温度、縦軸に気圧として表したグラフです。これを見れば、各気圧で温度を変化させるとどのような変化が起きるか、融点/沸点がどの地点になるかが分かるわけです!

日常では0℃で氷が溶けて、100℃で蒸発するのが当たり前だと思っていますが、気圧によってその当たり前が変わってくるんです。
液体にならない気圧もありますし、気圧を上げていくと氷が水に変化するという驚くべき現象も起きます。
このように、「固体」「液体」「気体」というのは結構変動的なものなんですね!
- 状態図 = 横軸を温度、縦軸を気圧として、物質の状態がどうなるか表した図
- 気圧によって、どのように状態が変化するかが変わる
- 水の場合は気圧が高くなると、固体から液体に変化することがある
⇒「物質の状態」カテゴリ記事一覧
その他関連カテゴリ